1. 流量調節によるリポソームの粒径調節
目的
iLiNPデバイスの特徴である粒径制御性を調べるために、流量変化によるリポソーム平均粒径の変化を測定しました。
実験方法
・脂質:POPC
・流路チップ:iLiNP1.0S, iLiN1.0SW(流路幅拡張タイプ)
・フロー条件:TFR=0.1-7.8mL/min, FRR=5
・iLiNPデバイスでPOPC/エタノール溶液と生理食塩水を混合後、生成したPOPCリポソームの平均粒径を測定。
結果
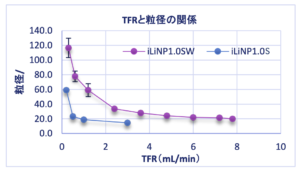
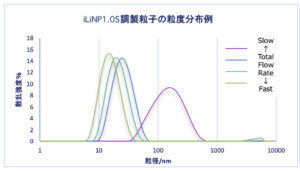
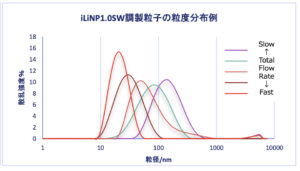
・どちらの流路チップも総流量を変えることにより平均粒径を大きく変化させることができました。
2. 流量調節による核酸内包脂質ナノ粒子の粒径調節
目的
iLiNPデバイスの特徴である粒径制御性を調べるために、流量変化による核酸内包脂質ナノ粒子(LNP)平均粒径の変化を測定しました。
実験方法
・脂質:イオン化脂質+ヘルパー脂質
・核酸:poly(A)
・流路チップ:iLiNP-RoA(新型流路)
・フロー条件:TFR=0.3-20mL/min, FRR=3
・iLiNPデバイスで脂質/エタノール溶液とpoly(A)/酢酸緩衝液を混合後、生成したpoly(A)内包脂質ナノ粒子の平均粒径を測定。
結果
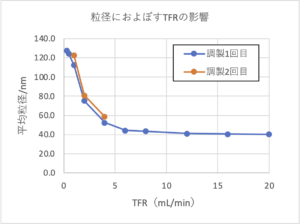
・核酸内包LNPの場合でも総流量を変えることにより平均粒径を大きく変化させることができました。
・作製依頼が多い粒径80〜100nm付近を中心に製造再現性を確認したところ問題ないことが確認されました。
※粒径変化幅は使用する脂質、内包核酸、仕込み濃度等によって大きく変化します。例えば分子量が大きい内包物の場合などでは粒径が期待よりも小さくならない場合があります。
3. iLiNPによるmRNA内包脂質ナノ粒子の製造、及び生体内でのmRNA発現量に対する残存エタノールの影響評価
目的
マイクロ流路デバイスを使用したmRNA内包脂質ナノ粒子懸濁液の製造では脂質を溶解する際に使用した有機溶媒(主に使われるのはエタノール)が懸濁液中に10〜25%残存します。
残存有機溶媒は通常、透析や限外濾過等により除去されますが、除去プロセスを省略できれば製造コスト削減につながります。
そこで、製造後速やかに接種する前提で、エタノールを含んだままのmRNA内包脂質ナノ粒子懸濁液(接種液)を試作しその性能を検証しました。
実験方法
・脂質: イオン化脂質+ヘルパー脂質
・核酸:Fluc mRNA (5moU)
・流路チップ:LM-iLiNP003同等品
・フロー条件:TFR=0.5mL/min、FRR=3
・iLiNP後処理:PBSバッファーで透析
・iLiNPデバイスで脂質/エタノール溶液と核酸/酢酸緩衝液を混合後、透析を行い、その後脂質ナノ粒子懸濁液にエタノール(最終濃度9%または18%)を添加。
・脂質ナノ粒子懸濁液(mRNA量として0.01 mg/マウス)をICRマウスの後肢大腿部に単回筋肉内注射で接種し、1日後、3日後、1週間後、2週間後にルシフェラーゼの発現量をマウス全体からの発光量として定量。
結果
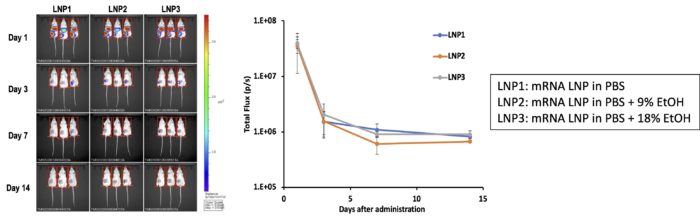
・接種1日後に強い発光が見られたことから、mRNAを細胞内に送達し発現させるのに十分な性能を有する脂質ナノ粒子をiLiNPで製造できることが確認できました。
・エタノールを添加した接種液も同等の発光が見られたことから、iLiNPによって製造されたmRNA内包脂質ナノ粒子は比較的高濃度のエタノールが残存していてもその性能が維持されていることがわかりました(特願2023-025886)
4. in vitroでのエクソソーム再構成を目標とした核酸内包アニオン性脂質ナノ粒子の試作
目的
細胞が分泌するエクソソームなどの細胞外小胞(脂質ナノ粒子)は様々な生理活性を示すことから、細胞培養液由来エクソソームを単離精製して医薬品として使用する試みが盛んになっています。一方で細胞培養コストが高いこと、細胞及び培養液由来の不純物が炎症などの副作用の原因になりうること、分泌されるエクソソームの個々の粒子の構成成分が不均一であり品質管理が難しいといった課題があります。
そこで高純度のエクソソーム構成成分をiLiNPデバイスを用いて混合・ナノ粒子化(エクソソーム再構成)し、低コストかつ高純度のエクソソーム模倣粒子(核酸内包アニオン性脂質ナノ粒子)を作製する技術の確立を目指しています。
現在は北海道大学にて精力的に研究開発が行われています。

5. O/W型エマルションの試作
目的
iLiNPを用いると脂質ナノ粒子以外の粒子(液滴)も作製可能です。その一例としてO/W型エマルション(オイル乳化)の試作を行いました。iLiNPよる乳化方法はオイルと水を界面活性剤存在下で激しく流路内混合し微細液滴化する方法です。
実験方法
エマルション製造用のiLiNP(非売品)を使用し、界面活性剤存在下でベビーオイル(流動パラフィン)等のオイルと水を混合・乳化してO/W型エマルションを得ました。
結果

写真1:流量条件を変えて作製したベビーオイル(流動パラフィン)のO/W型エマルション。合成界面活性剤使用。オイル濃度約18%。
条件A,Bは大粒径液滴が得られる条件のためクリーミングが見られます。一方、条件C,D,Eでは比較的小粒径かつ均一な液滴が得られるためクリーミングが見られません。
![]()
写真2:写真1のサンプルの実体顕微鏡観察画像。
条件A,Bは大粒径液滴の共存が明らかだが、条件C,D,Eは大粒径液滴の共存が抑えられ、かつ粒子径が均一化しています。
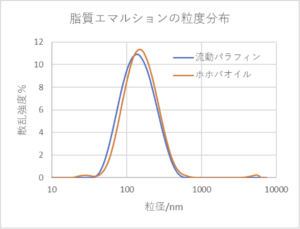
グラフ:化粧品原料として使用される天然由来脂質を界面活性剤にして作製したO/W型エマルションの粒径分布。動的光散乱法(DLS)による測定。オイルや界面活性剤の種類を変えてもエマルション製造が可能な汎用性が高い製造方法です。
・iLiNPは流量調節による混合状態の制御能力が優れているため「流路に流すだけ」の1ステップで狙った粒径の液滴を得ることが可能です。その結果、大粒径液滴が共存することで生じやすい「クリーミング」が起こりにくくなることが期待できます。
・手のひらサイズのマイクロ流路デバイスを使用するため、原料液量が〜1mL程度と極めて少量でもエマルション化条件検討が可能な点も魅力です。その小ささからオンサイトでのエマルション少量生産も可能です。もしスケールアップが必要な場合は流路チップの並列化・積層化により需要に応じたフレキシブルな対応が可能です。
6. PLGA/PLAマイクロスフェア(徐放製剤)の試作
目的
iLiNPを用いるとマイクロメートルオーダーの粒子も作製可能です。その一例として生分解性ポリマーであるPLGA (ポリ乳酸/グリコール酸共重合体)を用いたマイクロスフェアの試作を行いました。PLGAマイクロスフェアは薬剤を内包することにより徐放製剤として使用することができます。
実験方法・結果
PLGAを有機溶媒に溶かしカモスタット水溶液(モデル薬剤)と混合してW/O型エマルションを形成後、それを更にPVA水溶液中に懸濁させてW/O/W型エマルションを形成しました。その後脱溶媒することで平均粒径約0.5μm、薬剤内包率>99%のPLGAマイクロスフェアを得ました。
各乳化プロセスではiLiNPデバイスを使用し、更にiLiNPデバイスを直列化することで原料液からワンステップでW/O/Wエマルションを連続調製することに成功しました。
送液条件等を調節することによりマイクロスフェアの粒径を更に大きくすることも可能です。

7. 乳化香料の試作
目的
エマルション作製技術の応用例として乳化香料を試作してみました。
実験方法・結果
油溶性香料(エタノール含有)と水を可食性乳化剤存在下、エマルション製造用のiLiNP(非売品)を用いて混合乳化し乳化香料を得ました。調製したサンプルにはエタノールが25%程度含まれていますが、そのまま4℃で長期間(※)保存しても粒子の粒径増大や相分離(クリーミング)が見られず、粒径分布は単峰性を維持しています。また透析でエタノールを除去したサンプルも同様の安定性を示します。
※サンプルによって10日~1ヶ月程度。それ以上の期間の安定性試験は未実施。
今回試作した乳化香料の高い安定性はiLiNPの高い粒径制御特性が寄与していると推測されます。


